Змінити пароль!
Скинути пароль!


Бенралізумаб забезпечує досягнення гістологічної ремісії при еозинофільному гастриті та може стати інноваційним методом лікування цього захворювання.
В інноваційному дослідженні, результати якого опубліковані в журналі The Lancet Gastroenterology & Hepatology, повідомляється про потенційний новий метод лікування еозинофільного гастриту. У цьому дослідженні, виконаному Kara L. Kliewer, отримано нові дані про роль еозинофілів у розвитку захворювань шлунково-кишкового тракту та представлено новий метод терапії, здатний покращити результати лікування. Терапія бенралізумабом забезпечила досягнення гістологічної ремісії, що характеризується відсутністю тканинної еозинофілії, у більшості пацієнтів з еозинофільним гастритом.
У цьому плацебо-контрольованому рандомізованому подвійному сліпому дослідженні оцінювали ефективність та безпеку бенралізумабу у пацієнтів з діагностованим еозинофільним гастритом. У дослідження були включені пацієнти віком від 12 до 60 років з гістологічно активним еозинофільним гастритом із клінічними проявами та еозинофілією крові. Учасників рандомізували для отримання підшкірних ін'єкцій бенралізумабу у дозі 30 мг або плацебо один раз на 4 тижні протягом 12 тижнів (3 ін'єкції). Основною метою дослідження було визначення частки пацієнтів, які досягли гістологічної ремісії (визначуваної як максимальна кількість еозинофілів у слизовій оболонці шлунка менше 30 у полі зору при великому збільшенні) до 12-го тижня.
Додаткові цілі дослідження включали оцінку змін максимальної кількості еозинофілів, гістологічної картини еозинофільного гастриту, оцінку за ендоскопічною еталонною шкалою еозинофільного езофагіту (EG-REFS), а також суб'єктивні оцінки пацієнтів, наприклад, оцінка тяжкості диспепсії (SODA) та Інформаційна система вимірювання результатів із суб'єктивною оцінкою пацієнтами (PROMIS) від вихідного рівня до 12-го тижня.
Пацієнти відповідали критеріям включення у дві фази відкритого продовженого дослідження, що тривали до 88 тижня. Протягом цих фаз усі пацієнти отримували бенралізумаб після початкового 12-тижневого подвійного сліпого періоду. Тридцять чотири пацієнти пройшли скринінг. Двадцять шість пацієнтів було рандомізовано до групи застосування бенралізумабу або плацебо (по 13 пацієнтів у кожній групі). Детальна інформація щодо гістологічної ремісії представлена в таблиці 1:
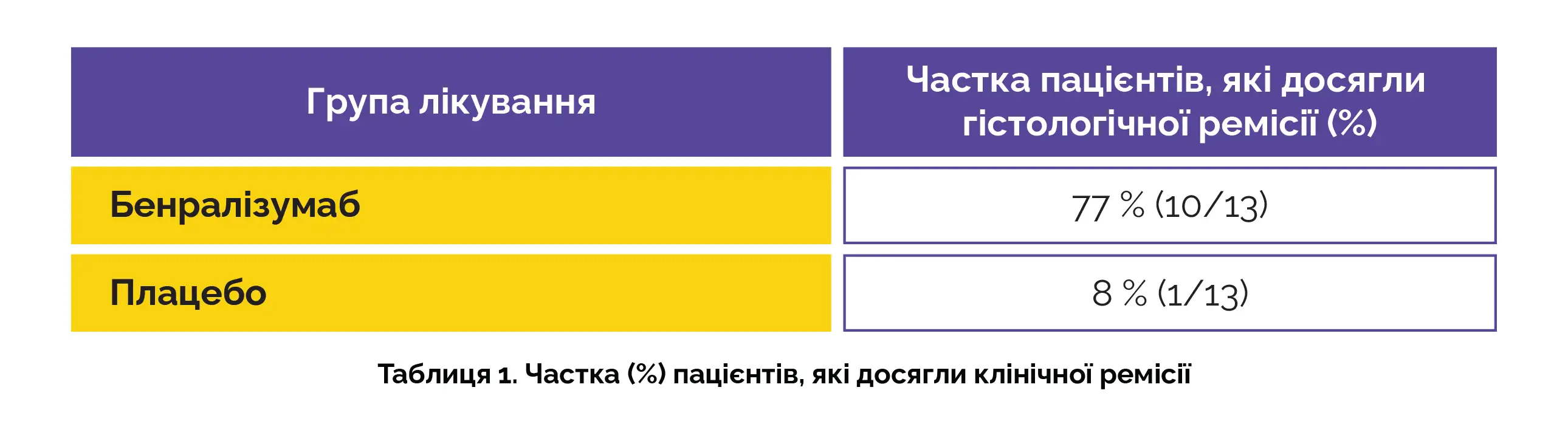
Примітно, що в групі застосування бенралізумабу спостерігалися значно більші зміни від вихідного рівня до 12-го тижня, ніж у групі плацебо, за різними параметрами, такими як максимальна кількість еозинофілів у слизовій оболонці шлунка, загальна гістологічна оцінка еозинофільного гастриту, гістологічна оцінка та кількість еозинофілів у крові. Зміни у структурній гістологічній оцінці еозинофільного гастриту, оцінці EG-REFS або результатах суб'єктивної оцінки пацієнтами не були статистично значущими. Небажані явища, що виникли під час лікування, спостерігалися у 11 із 13 пацієнтів (85 %) у групі застосування бенралізумабу та 6 із 13 пацієнтів (46 %) у групі плацебо.
Найчастішими небажаними явищами були біль голови, нудота і блювання. Смертельних наслідків, пов'язаних із лікуванням, зареєстровано не було. Жодне з небажаних явищ важкого ступеня (запаморочення та рабдоміоліз; аспірація) не було пов'язане з лікуванням. Терапія еозинофільного гастриту залишається складним завданням, проте застосування бенралізумабу може змінити підхід до лікування цього захворювання. Це дослідження знаменує собою значний крок уперед у розумінні цього захворювання та відкриває нові можливості для пацієнтів з еозинофільним гастритом.
Незважаючи на ці позитивні результати, збереження певних гістологічних, ендоскопічних та інших пов'язаних із захворюванням ознак дозволяє припустити існування додаткового, незалежного від еозинофілів шляху патогенезу, що сприяє прогресуванню захворювання. Ці дані свідчать про необхідність більш комплексного підходу, що передбачає ширше вивчення імунних реакцій 2-го типу, з урахуванням багатофакторної природи цього захворювання.
The Lancet Gastroenterology & Hepatology
Benralizumab for eosinophilic gastritis: a single-site, randomised, double-blind, placebo-controlled, phase 2 trial
Kara L. Kliewer і співавт.
Коментарі (0)