Змінити пароль!
Скинути пароль!


мРНК-вакцину проти COVID-19 можна безпечно застосовувати у пацієнтів, які отримують різні варіанти системної терапії злоякісних солідних пухлин.
Згідно з результатами проспективного багатоцентрового дослідження не меншої ефективності (VOICE), виконаного S. Oosting та співавт., застосування вакцини мРНК-1273 проти COVID-19 безпечне у пацієнтів зі злоякісними солідними пухлинами, які отримують хіміотерапію, імунотерапію або хіміоімунотерапію, та забезпечує високу частоту сероконверсії, порівнянну з такою у контрольній групі (тобто в осіб без злоякісних новоутворень).
Пацієнти з онкологічними захворюваннями схильні до підвищеного ризику розвитку ускладнень інфекції, що викликається вірусом SARS-CoV-2. Тому було виконано дослідження з оцінки безпеки та імуногенності вакцини проти COVID-19 на основі матричної РНК (мРНК-1273) у пацієнтів, які отримують терапію злоякісних солідних пухлин.
Учасників розділили на чотири когорти: (i) когорта A: особи без злоякісних новоутворень; (ii) когорта B: пацієнти з солідними пухлинами, які отримували імунотерапію; (iii) когорта C: пацієнти, які отримували хіміотерапію; та (iv) когорта D: пацієнти, які отримували хіміоімунотерапію. Включені до дослідження учасники отримали 2 дози вакцини з інтервалом 28 днів.
Основною кінцевою точкою була відповідь з утворенням сироваткових антитіл класу IgG, специфічних до субодиниці S1 спайкового білка, який визначали як наявність >10 одиниць зв'язувальних антитіл (BAU)/мл через 28 днів після 2-ї дози вакцини. Також оцінювали нейтралізуючу здатність цих антитіл проти вірусу SARS-CoV-2, частоту розвитку небажаних явищ та специфічну Т-клітинну відповідь проти спайкового білка коронавірусу з утворенням гамма-інтерферону.
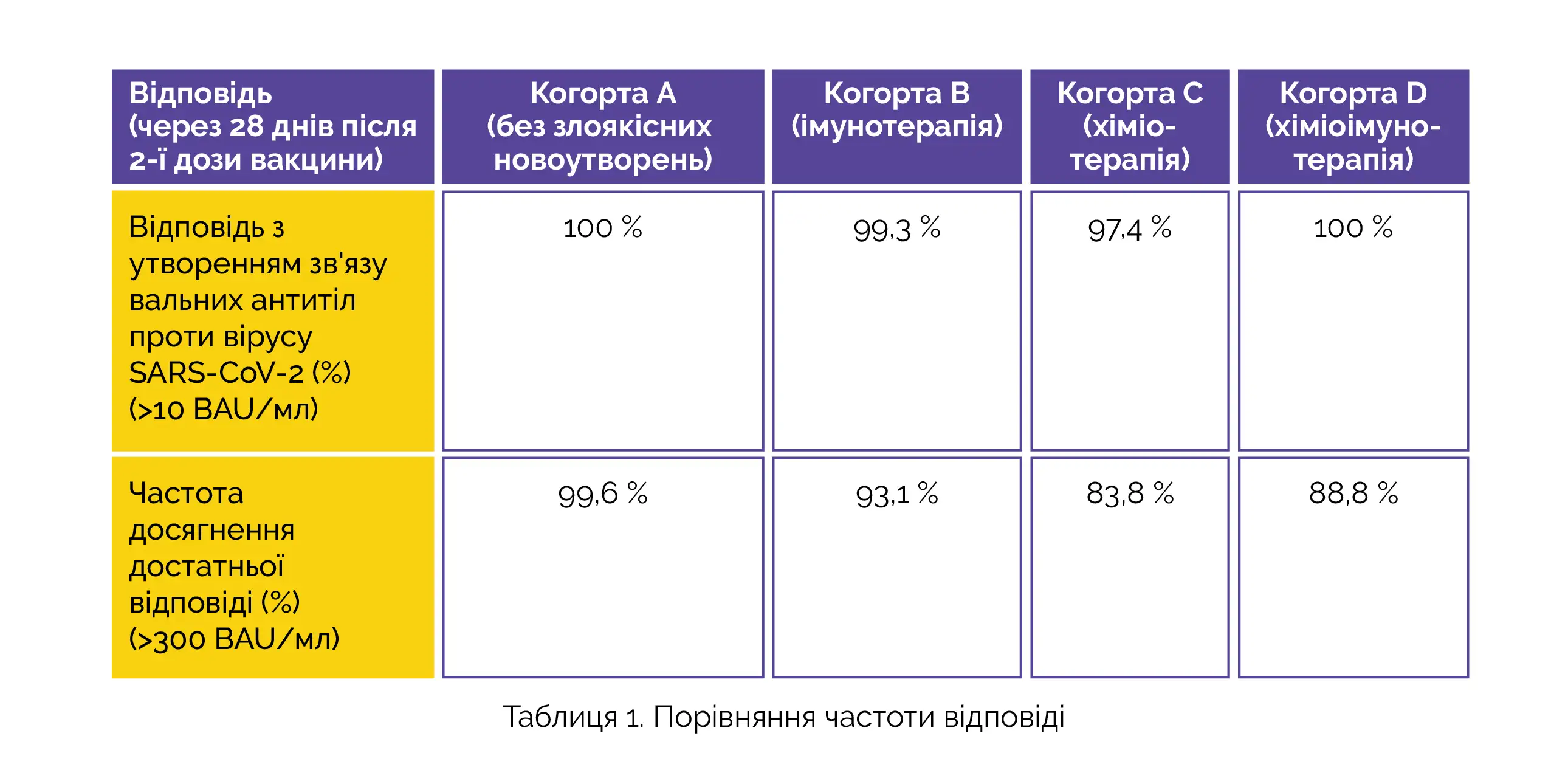
У 743 з 791 пацієнта було можливе проведення оцінки за основною кінцевою точкою, у тому числі у 240 пацієнтів з когорти A, 131 пацієнта з когорти B, 229 пацієнтів з когорти C та 143 пацієнтів з когорти D. У таблиці 1 наведено дані про частку пацієнтів, у яких спостерігався розвиток відповіді з утворенням антитіл проти вірусу SARS-CoV-2. Щоб розділити учасників із достатньою та недостатньою відповіддю з урахуванням нейтралізуючої здатності антитіл, визначили граничну величину відповіді, рівну 300 BAU/мл.
У когортах A, B, C та D розвиток достатньої відповіді з утворенням антитіл після введення 1-ї дози вакцини спостерігався у 66%, 37,1%, 32,5% та 33,3% учасників відповідно. Дані про відповідь з утворенням антитіл після введення 2-ї дози вакцини представлені в таблиці 1.
У 46,7% учасників з недостатньою відповіддю та відсутністю відповіді спостерігалася специфічна Т-клітинна відповідь проти спайкового білка. Нових сигналів безпеки виявлено не було.
У кожній з когорт учасників із солідними пухлинами частка пацієнтів, які досягли відповіді з утворенням антитіл, що зв'язують вірус SARS-CoV-2, після отримання 2 доз вакцини, була не меншою, ніж у групі осіб без злоякісних новоутворень. Однак у меншої, але значної частини учасників розвитку достатньої відповіді не спостерігалося. У більшості учасників відзначали підвищення концентрації антитіл після введення 2-ї дози вакцини. Таким чином, введення додаткової, бустерної дози вакцини могло б забезпечити розвиток відповіді достатньої величини у пацієнтів із незадовільною відповіддю.
Портал PracticeUpdate
ESMO 2021: Messenger RNA COVID-19 Vaccine Safe for Patients on Treatment for Solid Tumors
S. Oosting і співавт.
Коментарі (0)