Змінити пароль!
Скинути пароль!


Подвійна нейтралізація інтерлейкінів бімекізумабом, імовірно, є перспективним терапевтичним підходом у лікуванні гнійного гідраденіту і має значний потенціал для досягнення виразної відповіді при оцінці за різними показниками.
При застосуванні в осіб з помірним і важким гнійним гідраденітом бімекізумаб (моноклональне антитіло класу IgG1, що селективно нейтралізує інтерлейкіни 17A і 17F) спостерігалося статистично значуще поліпшення за всіма показниками, включаючи строгі оцінки результатів. Метою даного плацебо-контрольованого подвійного сліпого дослідження II фази (з групою активного препарату порівняння) було вивчення ефективності та безпеки застосування бімекізумабу у лікуванні гнійного гідраденіту.
Дизайн дослідження включав скринінг протягом 2-4 тижнів, лікування протягом 12 тижнів та спостереження для оцінки безпеки протягом 24 тижнів. Зі 167 учасників, що пройшли скринінг, до дослідження було включено 90 учасників (віком 18-70 років) з гнійним гідраденітом, діагностованим за два або більше місяців до включення до дослідження. Учасників рандомізували в одну з наступних груп: (i) групу бімекізумабу (n = 46, 640 мг на 0-му тижні, 320 мг кожні два тижні); (ii) групу плацебо (n = 22) та (iii) групу препарату порівняння , адалімумаба (n = 22, 160 мг на 0-му тижні, 80 мг на 2-му тижні та 40 мг щотижня протягом 4-10-го тижня).
Пошукові змінні включали частку учасників, що досягли 75% зниження виразності захворювання (показник HiSCR75) згідно з модифікованими критеріями оцінки відповіді на лікування при гнійному гідраденіті (HiSCR), або частку учасників, які досягли 90% зниження виразності захворювання (показник HiSCR90) згідно з модифікованими критеріями оцінки HiSCR, оцінку з використанням індексу якості життя при захворюваннях шкіри (DLQI) та зміну ступеня інтенсивності болю. Основною кінцевою точкою дослідження була частка учасників, що досягли ≥50% скорочення кількості абсцесів і запальних вузлів у порівнянні з вихідним рівнем без збільшення кількості абсцесів або дренованих свищів (згідно з критеріями HiSCR) через 12 тижнів.
Загалом 88 учасників отримали щонайменше 1 дозу досліджуваного препарату. Число учасників, які завершили дослідження, включаючи період подальшого спостереження для оцінки безпеки, становило 79 учасників. Через 12 тижнів у групі бімекізумабу порівняно з плацебо частка учасників, які досягли поліпшення згідно з критеріями HiSCR, а також з урахуванням оцінки за міжнародною шкалою тяжкості гнійного гідраденіту (IHS4) була вищою, як представлено в таблиці 1:
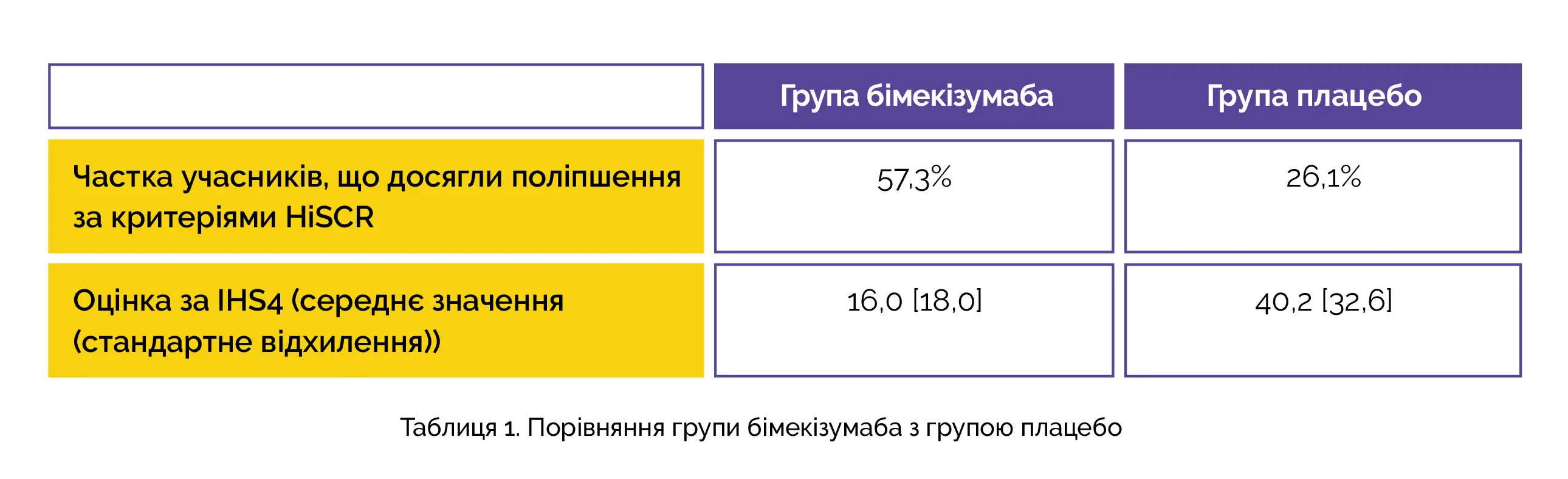
Порівняно з плацебо в осіб, які отримували терапію бімекізумабом, спостерігалося більш виразне поліпшення стану та досягнення найкращої, позитивної відповіді при проведенні суворої оцінки результатів. Частка учасників, що досягли показників HiSCR75 та HiSCR90, а також частота розвитку серйозних небажаних явищ у групах дослідження через 12 тижнів лікування представлені у таблиці 2.
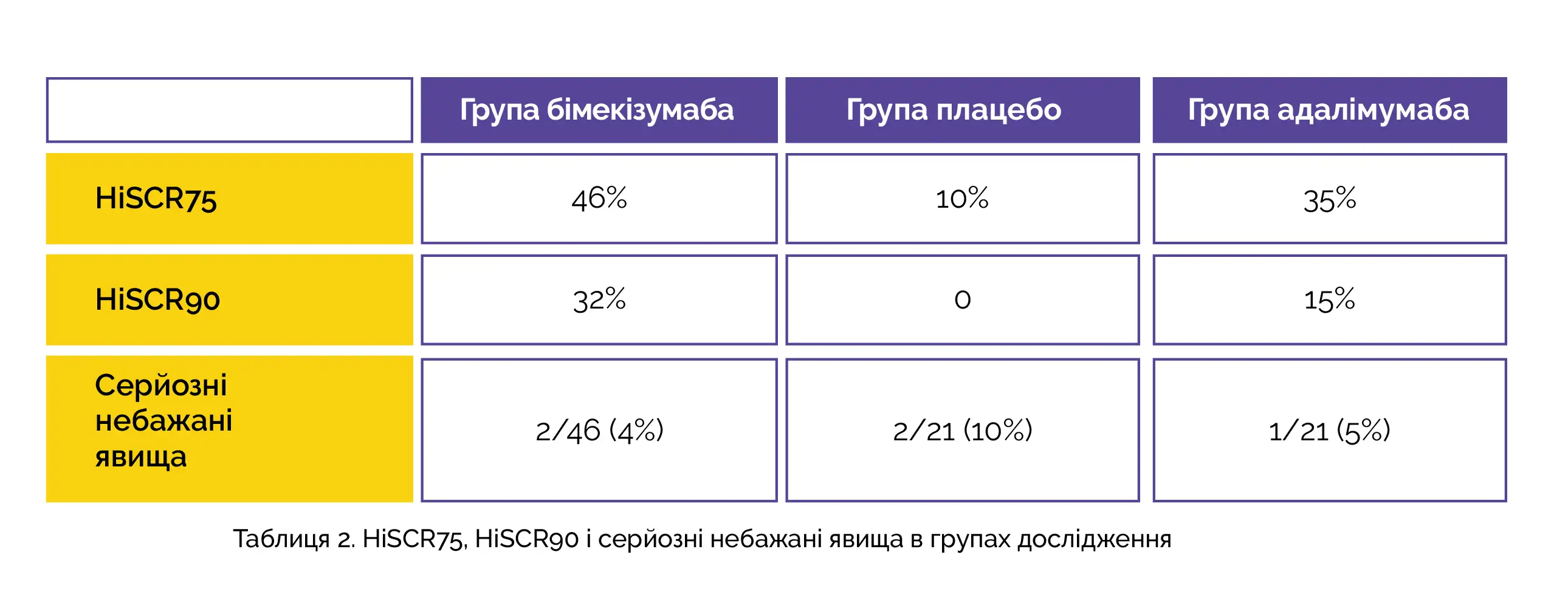
Слід зазначити, що один пацієнт припинив участь у дослідженні через розвиток небажаних явищ. Профіль безпеки бімекізумабу відповідав даним, отриманим у дослідженнях його застосування за іншими показаннями, що говорить про необхідність проведення додаткових досліджень лікування цим препаратом пацієнтів із гнійним гідраденітом.
JAMA Dermatology
Efficacy and Safety of Bimekizumab in Moderate to Severe Hidradenitis Suppurativa: A Phase 2, Double-blind, Placebo-Controlled Randomized Clinical Trial
Sophie Glatt і співавт.
Коментарі (0)