Змінити пароль!
Скинути пароль!


Lactobacillus plantarum як пробіотичний ад’ювант може допомогти в лікуванні інфекції H. pylori.
Нещодавнє рандомізоване контрольоване клінічне дослідження показало потенціал використання пробіотиків як допоміжного засобу для ерадикації інфекції Helicobacter pylori (H. pylori). Дослідження було спрямоване на вивчення ефективності Lactobacillus plantarum (L. plantarum) як додаткового засобу при лікуванні H. pylori. Це подвійне сліпе дослідження включало 51 дорослого хворого на диспепсію (18-70 років) з підтвердженою інфекцією H. pylori за допомогою біопсії шлунка. Учасники раніше не отримували лікування та дали дозвіл на участь, незалежно від статі чи етнічного походження.
Пацієнти в групі пробіотиків отримували потрійний режим ерадикаційної терапії (включав прийом амоксициліну 1000 мг двічі на день протягом 1 тижня, кларитроміцину 500 мг двічі на день протягом тижня та езомепразолу 20 мг двічі на день протягом першого тижня, а потім один раз на день протягом додаткових трьох тижнів) і штам L. plantarum Lp-G18 перорально, через капсули з концентрацією 5 × 108 колонієутворюючих одиниць (КУО), один раз на день протягом чотирьох тижнів.
На відміну від цього, контрольна група отримувала комбінацію з трьох препаратів (амоксицилін 1000 мг двічі на день протягом одного тижня, кларитроміцин 500 мг двічі на день протягом одного тижня та езомепразол 20 мг двічі на день протягом одного тижня, а потім один раз на день протягом додаткових трьох тижнів), разом із пероральним прийомом капсул плацебо, що містять мальтодекстрин, один раз на день протягом загалом чотирьох тижнів.
Ключовою кінцевою точкою було усунення H. pylori, що характеризується гістопатологічною відсутністю бактерій H. pylori через чотири тижні після лікування (через сім тижнів після завершення потрійної стандартної терапії). Вторинна кінцева точка включала оцінку виникнення або відсутності побічних явищ, включаючи зміни смаку/сухість у роті, діарею, відчуття газів у животі та епігастральний біль/нудоту.
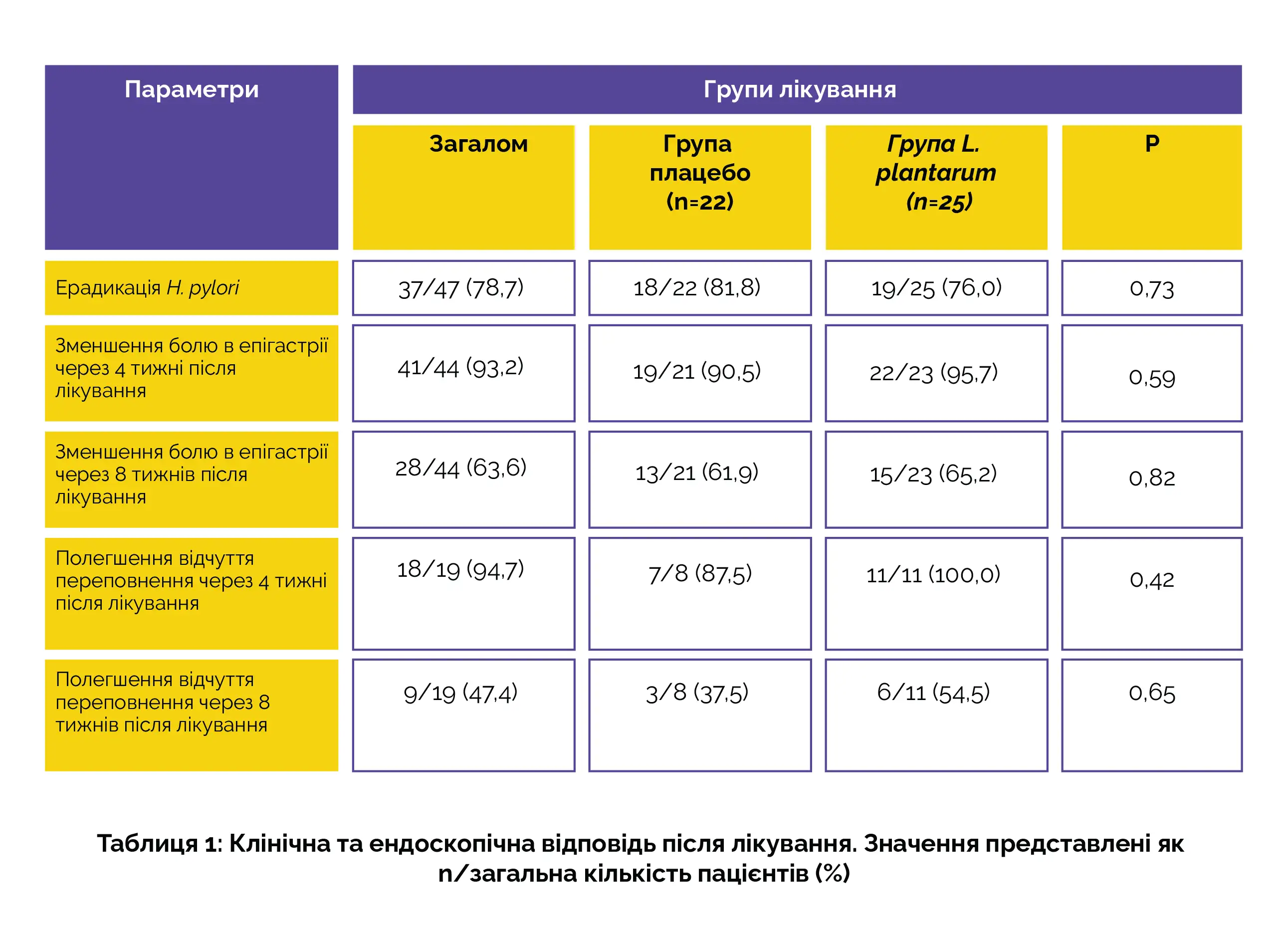
Із загальної кількості учасників це дослідження завершили 47 осіб. Двадцять сім пацієнтів (57,4%) були жінки. Загальний рівень ерадикації становив 78,7% (n=37), і він не мав істотної різниці між групами (p=0,73). Пацієнти, які повідомляли про початковий біль в епігастрії, показали покращення протягом перших чотирьох тижнів після лікування. Хоча в групі L. plantarum було зареєстровано більше покращень, різниця була незначною. Що стосується посилення симптомів епігастралгії протягом перших чотирьох тижнів після лікування, більше половини учасників залишалися без симптомів через 8 тижнів. Стійкість клінічного покращення також частіше спостерігалася в когорті, яка отримувала пробіотики, хоча і без демонстрації статистично значущої різниці.
Щодо осіб (n=19), які згадали про переповненість шлунка під час первинної консультації, лише один учасник у групі плацебо не продемонстрував покращення зазначених симптомів протягом перших чотирьох тижнів після лікування. Серед тих, хто спостерігав полегшення переповнення шлунка протягом перших чотирьох тижнів після лікування, приблизно половина залишалася без симптомів через вісім тижнів. Хоча в групі пробіотиків повідомлялося про стійке покращення, статистичного підтвердження отримано не було (табл. 1).
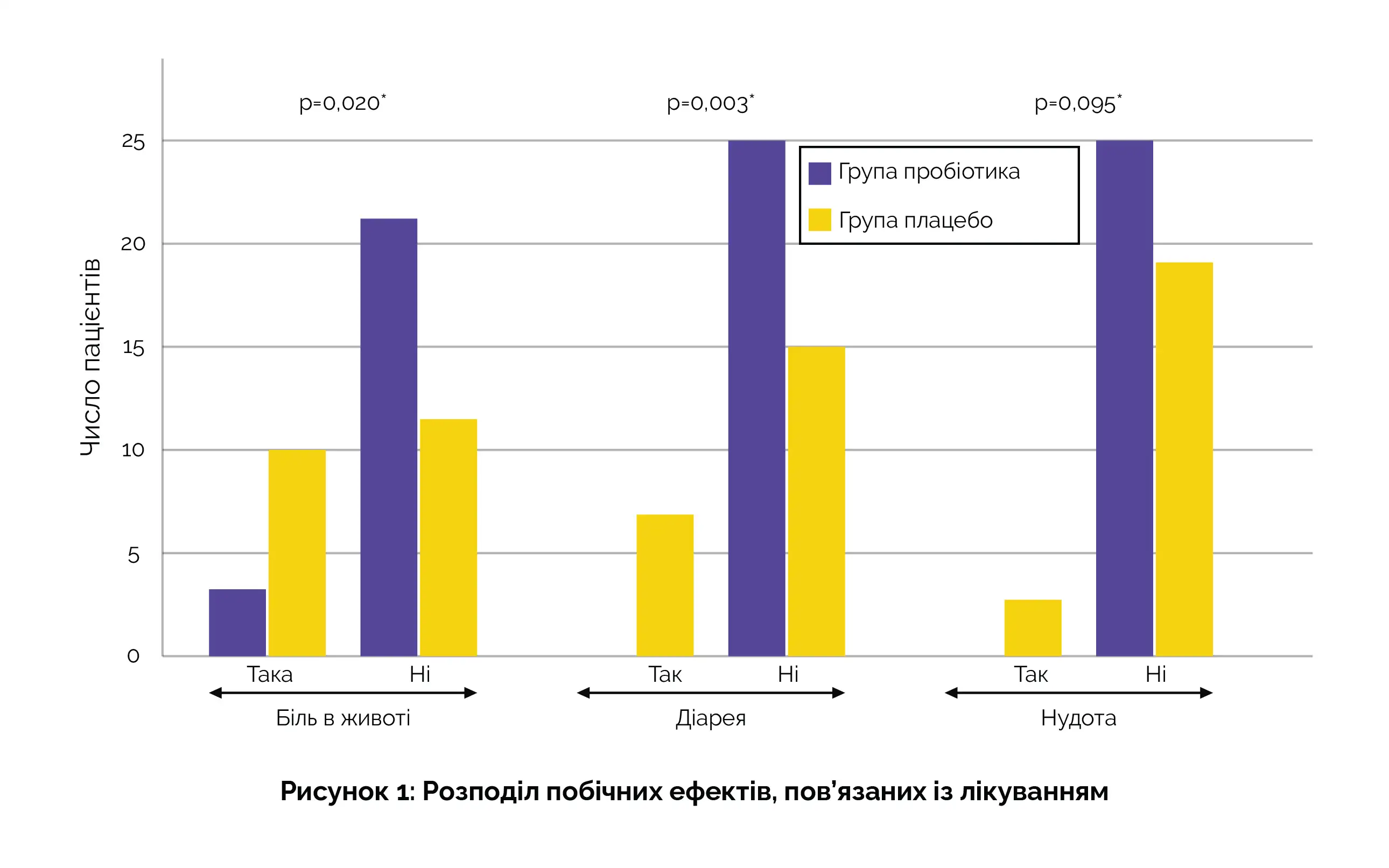
Додаткові обстеження показали, що серед осіб віком до 45 років рівень елімінації у тих, хто отримував пробіотики, становив 93,8%, на відміну від 70,0% у групі плацебо (p = 0,046). Що стосується основних побічних ефектів, було відзначено, що в групі пробіотиків невелика частина суб’єктів відчувала біль у животі (12%), і жоден не повідомляв про діарею чи нудоту, натомість у групі плацебо більша частка відчувала біль у животі (45,5%), деякі повідомили про діарею (31,8%), а у деяких розвинулася нудота (13,6%) після початку лікування (рис. 1).
Це дослідження розкриває можливе застосування пробіотиків як доповнення для ерадикації H, pylori та спонукає до вивчення посилених спільних ефектів пробіотиків у молодих людей,
Concilium
Lactobacillus plantarum associated with antimicrobial therapy in the eradication of Helicobacter pylori: a randomized clinical trial
Rodrigo Oliveira Ximenes et al,
Коментарі (0)