Змінити пароль!
Скинути пароль!


Коронавірус важкого гострого респіраторного синдрому-2 (SARS-CoV-2), вперше виявлений у м. Ухань (КНР), є збудником нової коронавірусної інфекції COVID-19. Епідемія захворювання призвела до мільйонів смертей у всьому світі
Фавіпіравір підвищує ймовірність вилікування COVID-19, особливо у пацієнтів з коронавірусною хворобою легкого або середнього ступеня тяжкості, завдяки впливу на швидкість елімінації вірусу.
Коронавірус важкого гострого респіраторного синдрому-2 (SARS-CoV-2), вперше виявлений у м. Ухань (КНР), є збудником нової коронавірусної інфекції COVID-19. Епідемія захворювання призвела до мільйонів смертей у всьому світі. Зважаючи на широкий спектр клінічних проявів коронавірусу – від клінічних симптомів гострого респіраторного дистрес-синдрому та важкої пневмонії до безсимптомного перебігу захворювання – легені, швидкість відновлення клітин яких дуже низька, є основними органами-мішенями вірусу. На початковій стадії пандемії патофізіологія та способи ефективного управління захворюванням не були відомі, а вакцина була відсутня. Система охорони здоров'я гостро потребувала ефективних та безпечних терапевтичних підходів до лікування захворювання, проте розробка нових противірусних агентів для боротьби з COVID-19 – тривалий процес.
SARS-CoV-2 (належить до сімейства коронавірусів) є РНК-вірусом з позитивним ланцюгом (+РНК). Ця одноланцюгова РНК відповідає за кодування протеаз і РНК-залежної РНК-полімерази (RdRp). І вірусна протеаза, і RdRp є ключовими мішенями перспективних лікарських препаратів. Противірусний препарат фавіпіравір, раніше відомий під назвою T-705, є попередником пуринового нуклеотиду фавіпіравіру рибофуранозил-5-трифосфату. Цей активний агент пригнічує РНК-полімеразу, тим самим інгібуючи реплікацію вірусу. У 2014 р. Агентство з лікарських засобів та медичних виробів Японії схвалило застосування фавіпіравіру в лікуванні повторної інфекції грипу.
Численні дослідження підтвердили його ефективність у боротьбі з РНК-вірусами, такими як вірус Ебола, та іншими вірусами, такими як респіраторно-синцитіальний вірус і риновірус. У ході досліджень in vitro з використанням культури клітин Vero E6 напівмаксимальна ефективна концентрація (EC50) фавіпіравіру проти SARS-CoV-2 склала 61,88 мкмоль/л. Таким чином, виявлено великий потенціал фавіпіравіру при застосуванні у лікуванні осіб, інфікованих коронавірусом.
ОБГРУНТУВАННЯ ДОСЛІДЖЕННЯ
Кількість досліджень з вивчення ефективності та безпеки застосування фавіпіравіру у пацієнтів з коронавірусною інфекцією обмежена. У зв'язку з цим було проведено мета-аналіз та систематичний огляд.
МЕТА ДОСЛІДЖЕННЯ
Дане дослідження включало систематичний огляд застосування фавіпіравіру у осіб, інфікованих коронавірусом, щоб отримати емпіричні докази ефективності препарату.
Пошук літератури
Два дослідники виконували пошук відповідних досліджень у базах даних Кокрейнівської бібліотеки, MedRxiv і PubMed з використанням ключових слів «коронавірус нового типу», АБО «нова коронавірусна інфекція», АБО «коронавірусна інфекція, що виникла», АБО «2019-nCoV», АБО «COV 19», АБО «SARS-CoV-2» та «фавіпіравір», АБО «авіган», АБО «T-705» за період з дати створення до 12 вересня 2020 р.
Списки літератури всіх включених досліджень, оглядів і реєстрів клінічних досліджень вивчали для виявлення клінічних досліджень ефективності або безпеки фавіпіравіру у пацієнтів з коронавірусною інфекцією. За допомогою пошукової системи Google Scholar дослідники також провели аналіз списків літератури досліджень, що задовольняли критеріям відбору, та виконали ручний пошук для підтвердження включення всіх відповідних досліджень.
Критерії включення
• У цей систематичний огляд включали дослідження, що відповідали наступним критеріям відбору.
• Дизайн та мова досліджень: обсерваційні дослідження, рандомізовані клінічні дослідження (РКД) та серії випадків із включенням понад 10 учасників, опубліковані англійською мовою.
• Популяція: пацієнти, заражені коронавірусною інфекцією (підтвердженою результатами лабораторних досліджень), які були госпіталізовані або отримували лікування в амбулаторних умовах.
• Втручання: введення фавіпіравіру.
•Порівняння видів втручання: ремдесивір, плацебо, лопінавір/ритонавір, стандартна медична допомога (СМД), інші доступні противірусні препарати, гідроксихлорохін, фавіпіравір у різних дозах, комбінована терапія з фавіпіравіром або без препарату порівняння.
• Основна кінцева точка: елімінація вірусу та клінічне покращення, у тому числі покращення результатів комп'ютерної томографії грудної клітки.
• Додаткова кінцева точка: будь-яка змінна результату.
Критерії виключення
Дослідження виключали у таких випадках:
• менше 10 учасників у серії випадків;
• відсутність даних про змінні результату;
• неповні або недостатні дані дослідження.
Відбір досліджень та вилучення даних
Вилученням даних займалися двоє дослідників. Зберігання статей, відібраних у результаті пошуку, здійснювали у програмі управління цитуванням. Після видалення надлишкових статей було проведено оцінку назв, анотацій, а потім і повнотекстових статей. Було вилучено такі дані: центр проведення та дизайн дослідження, критерії включення/виключення кожного дослідження та період спостереження.
Відомості про результати вносили до заздалегідь розроблених форм збору даних. Верифікацію точності даних проводили за допомогою оцінки форм збору даних кожного дослідника. Будь-які розбіжності дослідники вирішували під час обговорення.
Дані та статистичний аналіз
Для оцінки відношення шансів (ВШ) або частки учасників (%), що досягли основної кінцевої точки, при 95% довірчому інтервалі (ДІ), використовували модель з випадковими ефектами (загальний метод зворотної дисперсії). Для визначення частки (%) варіабельності наслідків у пацієнтів, інфікованих SARS-CoV-2, стандартну помилку розраховували за методом Агресті-Коулла.
Гетерогенність у вихідних дослідженнях оцінювали з використанням критерію I2.
Оцінку систематичної помилки публікації провели з використанням лійкоподібної діаграми. Рівні значущості у всіх аналізах були двосторонніми, а p-значення <0,05 приймалося статистично значущим. Усі статистичні аналізи проводили за допомогою програмного забезпечення Review Manager.
Оцінка ризику систематичних помилок та оцінка якості
Ризик систематичних помилок (низький, середній або високий ризик) при оцінці загального ефекту противірусного препарату на клінічні покращення та елімінацію вірусу визначали за допомогою інструмента оцінки ризику систематичних помилок Кокрейну.
Два дослідники незалежно один від одного провели оцінку ризику систематичних помилок з подальшим обговоренням та вирішенням розбіжностей. Достовірність доказів того, що противірусний препарат фавіпіравір сприяв клінічному поліпшенню та скорочував час елімінації вірусу, перевіряли з використанням системи оцінки, розробки та експертизи рекомендацій (GRADE).
Кінцеві точки дослідження
• Основна кінцева точка включала оцінку елімінації вірусу та частоти клінічного покращення.
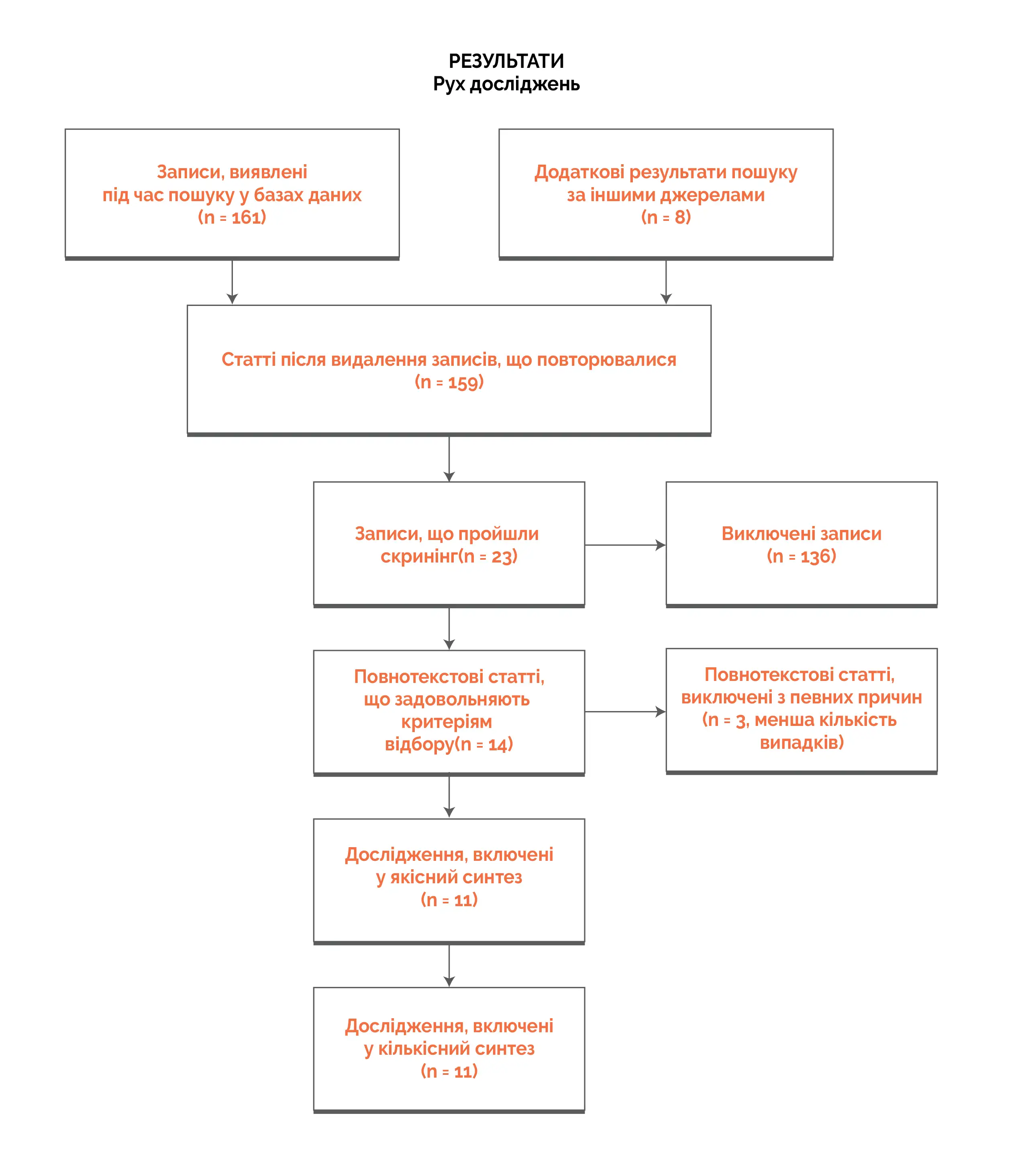
Результати
Характеристики досліджень
• З 163 статей, що пройшли скринінг, 11 досліджень задовольняли критеріям відбору. Одинадцять відібраних досліджень включали 3 РКД, 6 досліджень серій випадків або обсерваційних досліджень, 1 нерандомізоване контрольоване дослідження з вивченням груп до і після втручання та одне нерандомізоване контрольоване дослідження.
• З 11 досліджень, які відповідали критеріям відбору, у п'яти була присутня група лікування препаратом порівняння.
• У порівняльних дослідженнях як препарати порівняння використовували лопінавір/ритонавір, балоксавір марбоксил, уміфеновір та монотерапію гідроксихлорохіном або в комбінації з азитроміцином.
• Фавіпіравір зазвичай застосовували у стандартній дозі, показаній для лікування інфекції грипу (1600 мг 2 р/добу у перший день, потім 600 мг 2 р/ добу). При цьому в декількох дослідженнях, що задовольняли критеріям відбору, препарат використовували у дозі 1800 мг 2 р/добу в перший день, потім 800 мг 2 р/добу.
• В одному з досліджень вивчали дозу навантаження. У 11 дослідженнях, що задовольняли критеріям відбору, тривалість терапії фавіпіравіром у більшості випадків становила 14 днів.
Вплив втручання на кінцеві точки
• Порівняно з групами порівняння, елімінація вірусу на 7-й день від початку терапії у учасників групи фавіпіравіру була статистично значно більш ефективною. На 14-й день відмінностей не було.
• Хоча в учасників, які отримували фавіпіравір, було відзначено статистично значуще поліпшення в обох періодах (на 7-й та 14-й день), ступінь поліпшення на 14-й день був більш виразним, ніж на 7-й день.
• У групі застосування фавіпіравіру розрахункова частка учасників з клінічним поліпшенням на 7-й та 14-й день склала 54,33 % та 84,63 % відповідно в порівнянні з 34,4 % та 65,77 % відповідно у групі застосування препарату порівняння.
• У групі застосування фавіпіравіру розрахункова частка учасників з елімінацією вірусу SARS-CoV-2 склала 65,42 % на 7-й день та 88,9 % на 14-й день порівняно з 43,42 % та 78,79 % відповідно в групі застосування препарату порівняння.
При обмеженості доступних доказів результати цього дослідження доводять, що фавіпіравір має відмінний потенціал для лікування інфекції, спричиненої коронавірусом SARS-CoV-2. Встановлено, що у пацієнтів із COVID-19 середнього ступеня тяжкості фавіпіравір прискорює елімінацію вірусу після семи днів терапії. Фавіпіравір також сприяє клінічному покращенню, зокрема, після 14 днів терапії. Фавіпіравір ефективний проти численних РНК-вірусів, пригнічує активність РНК-залежної РНК-полімерази і є одним з перспективних препаратів для лікування коронавірусної інфекції.
Хоча у зазначених дослідженнях використовували різні препарати порівняння, було виявлено, що застосування фавіпіравіру було пов'язане зі статистично значно вищою ймовірністю елімінації коронавірусу SARS-CoV-2 на 7-й день терапії. З іншого боку, частка (%) елімінації вірусу до 14-го дня була статистично значуще вираженою. Пік вірусного навантаження SARS-CoV-2 припадає приблизно на період появи симптомів або кілька днів після, а через два тижні сліди вірусу вже не можна виявити. Крім того, у більшості включених до огляду досліджень тривалість лікування фавіпіравіром становила 14 днів. Обмежена кількість статистично значущих відмінностей у частках елімінації SARS-CoV-2 між видами лікування на 14-й день може відображати природний перебіг і виділення вірусу при COVID-19. Зазначалося, що медіана часу до елімінації вірусу в учасників досліджень, які отримували фавіпіравір у 1-й день після початку розвитку COVID-19, склала 12,8 діб порівняно з 17,8 діб у пацієнтів, які розпочали лікування на 6-й день.
Оскільки фавіпіравір є препаратом для внутрішнього застосування, він підходить для застосування у пацієнтів з безсимптомною або легкою формою коронавірусної інфекції. Застосування препарату призводило до статистично значущого клінічного покращення через 14 днів, але не через 7 днів терапії. З іншого боку, період до нормалізації температури тіла становив дві доби. Описи клінічних поліпшень у дослідженнях відрізняються. Однак змінні, що характеризують клінічне поліпшення, включали рівень сатурації киснем, частоту дихальних рухів, поліпшення результатів комп'ютерної томографії грудної клітини і ступінь полегшення кашлю. Зазначені клінічні симптоми та ознаки були обумовлені пневмонією або ураженням легень.
У поточному дослідженні у більшості учасників була коронавірусна інфекція легкого або середнього ступеня тяжкості, і терапія фавіпіравіром, ймовірно, сприяла нормалізації функції легень протягом 14 днів після початку лікування. У дослідженні застосування фавіпіравіру на ранньому та пізньому етапі захворювання у пацієнтів з безсимптомною або легкою формою коронавірусної інфекції було виявлено статистично значущі відмінності щодо тривалості госпіталізації. Зареєстровані результати довели необхідність раннього початку терапії фавіпіравіром навіть у пацієнтів з безсимптомною або легкою формою коронавірусної інфекції до початку розвитку пневмонії або посилення ураження легень. Крім того, стандартна доза фавіпіравіру, показана для лікування грипу, становила 1600 мг 2 р/добу в 1-й день. Потім доза становила 600 мг 2 р/добу протягом п'яти днів.
Стандартну схему застосування використовували у більшості досліджень, які відповідали критеріям відбору для огляду. Зазвичай тривалість терапії становила 14 днів. У той же час у низці досліджень доза була збільшена до 1800 мг 2 р/добу в 1-й день з наступним прийомом 800 мг 2 р/добу. Залежно від типу інфекції було запропоновано кілька схем застосування. Як передбачалося, доза навантаження 2400-3000 мг кожні 12 годин (дві дози) була показана для лікування коронавірусної інфекції, після чого вводили підтримуючу дозу 1200-1800 мг кожні 12 годин. У роботі Rattanaumpawan та співавтр. наводяться результати оцінки застосування навантажувальної дози фавіпіравіру, згідно з якими для досягнення раннього клінічного поліпшення низька навантажувальна доза фавіпіравіру (≤45 мг/кг/добу) була фактором несприятливого прогнозу. Для оптимального лікування коронавірусу SARS-CoV-2 слід розглянути можливість застосування найвищих доз дозового діапазону. У оглядовій статті профіль безпеки фавіпіравіру характеризували як допустимий з точки зору загальної кількості побічних ефектів та важких побічних ефектів порівняно з іншими лікарськими засобами, що застосовуються у короткостроковій терапії. Це не суперечило поточному дослідженню, і лише в одному дослідженні гіперурикемія спостерігалася у 84,1% пацієнтів із безсимптомною чи легкою формою коронавірусної інфекції. Хоча клінічний досвід застосування фавіпіравіру для боротьби з інфекцією, викликаною SARS-CoV-2, обмежений, у цьому дослідженні не спостерігалося шкідливих для організму небажаних явищ, пов'язаних із застосуванням фавіпіравіру. Крім того, фавіпіравір має лише умовне схвалення на виробництво та клінічне використання у лікуванні грипу у зв'язку з ризиком токсичного впливу на ембріон та тератогенність.
Згідно з результатами поточного дослідження, фавіпіравір сприяє елімінації вірусу протягом семи днів та клінічному покращенню протягом 14 днів, зокрема, у осіб з коронавірусною інфекцією легкого або середнього ступеня тяжкості. Ранній початок терапії фавіпіравіром може вплинути на результат захворювання, викликаного коронавірусом SARS-CoV-2. У спробі розширити роль фавіпіравіру у боротьбі з коронавірусною інфекцією автори цього дослідження підтвердили високий потенціал використання фавіпіравіру у пацієнтів з безсимптомною, легкою або середньою формою захворювання. Застосування лікарської форми фавіпіравіру для застосування внутрішньо принесло додаткову користь пацієнтам з безсимптомною або легкою формою COVID-19. Однак існує гостра необхідність проведення додаткових, добре структурованих досліджень, зокрема, присвячених вивченню варіантів терапії з різною тривалістю і різними дозами у пацієнтів з виразними ступенями тяжкості захворювання.
• Лише невелика кількість досліджень включала групу порівняння, а тривалість терапії та доза фавіпіравіру відрізнялися.
• Не у всіх включених дослідженнях часові точки контролю основних кінцевих точок були строго 7-й та 14-й день від початку терапії.
• Визначення клінічного поліпшення у дослідженнях відрізнялося.
Фавіпіравір може сприяти елімінації вірусу протягом семи днів та клінічному поліпшенню протягом 14 днів, і, отже, препарат імовірно має високу цінність та сприяє досягненню сприятливих результатів у пацієнтів, інфікованих коронавірусом SARS CoV-2.
BMC Infectious Diseases
Favipiravir for the treatment of patients with COVID-19: a systematic review and meta-analysis
Toshie Manabe і співавт.
Коментарі (0)